Энергетические и температурные условия процесса кристаллизации.
Любое вещество может находиться в трех агрегатных состояниях — газообразном, жидком и твердом. Изменение агрегатного состояния происходит при определенных температурах. Температура перехода зависит от давления, но при постоянном давлении они вполне определенны.
Переход металла из жидкого состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Плавление — процесс, обратный кристаллизации.
В природе все самопроизвольно протекающие превращения (кристаллизация и плавление) обусловлены тем, что новые состояния в новых условиях являются энергетически более устойчивыми, обладают меньшим запасом энергии.
Энергетическое состояние системы, имеющее огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется особой термодинамической функцией G, называемой свободной энергией. В условиях постоянного давления:
G = U – T ⸳ S
где — U — внутренняя энергия системы (вещества), т. е. полная энергия, равная сумме кинетической и потенциальной энергии частиц, составляющих данную систему: Т — абсолютная температура в системе, S — энтропия, т. е. мера внутренней неупорядоченности в системе.
Чем больше свободной энергии системы, тем система менее устойчива. С изменением внешних условий свободная энергия системы изменяется по сложному закону, но различно для жидкого и кристаллического состояний. Схематический характер изменения свободной энергии жидкого и твердого состояний в зависимости от температуры показан на рис. 1.
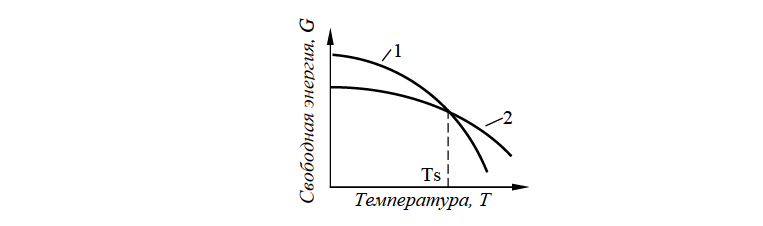
состояний в зависимости от температуры.
Из графика видно, что при температуре Ts свободные энергии жидкого и твердого состояний равны, металл находится в равновесии. Ts — равновесная или теоретическая температура кристаллизации, при которой Gж = Gтв.
Для начала кристаллизации необходимо уменьшение свободной энергии системы. Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением. Разница между равновесной Ts и реальной Тк температурой кристаллизации называется степенью переохлаждения ΔТ. Степень переохлаждения зависит от природы металла, она увеличивается с повышением частоты металла и ростом скорости охлаждения. Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах «Время — Температура» (рис. 2).
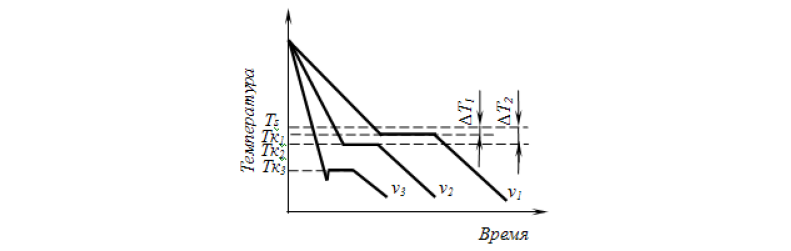
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры. При достижении температуры кристаллизации на кривой «температура-время» появляется горизонтальная площадка, так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. Жидкий металл обладает большей внутренней энергией, чем твердый, поэтому при кристаллизации выделяется теплота. По окончании кристаллизации температура снова начинает снижаться и твердое кристаллическое вещество охлаждается.
Механизм и основные закономерности процесса кристаллизации.
В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объема, в пределах которых расположение атомов вещества во многом аналогично их расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них (наиболее
крупные) становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами).
Образование зародышей способствует флуктуации энергии, т. е. отклонение энергии группировок атомов в отдельных зонах жидкого металла от некоторого среднего значения. Размер образовавшегося зародыша зависит от величины зоны флуктуации.
Процесс образования кристаллов путем зарождения центров кристаллизации и их роста можно рассмотреть с помощью схем (рис. 3).

Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
- по мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов, поэтому процесс вначале ускоряется до тех пор, пока в какой-то момент взаимное столкновение растущих кристаллов не начинает заметно препятствовать их росту, которое замедляется; тем более, что и жидкости, в которой образуются новые кристаллы, становится все меньше;
- в процессе кристаллизации кристалл, окруженный жидкостью, имеет правильную форму, но по мере столкновения и срастания кристаллов их правильная форма нарушается и оказывается в зависимости от условий соприкосновения растущих кристаллов. Кристаллы неправильной формы называются кристаллитами или зернами.
Скорость процесса и окончательный размер кристаллов при затвердевании определяется соотношением между скоростью образования центров кристаллизации и скоростью роста кристаллов (рис. 4).
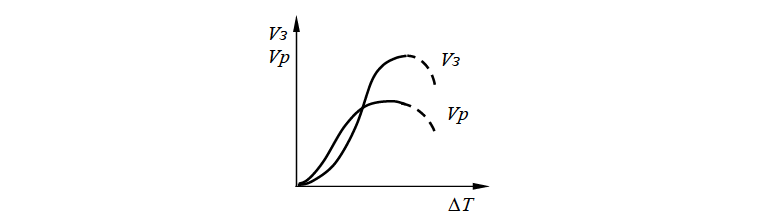
При небольших степенях переохлаждения, когда зародыш критического размера велик, а скорость образования зародышей мала, в результате затвердевания образуется крупнокристаллическая структура. Чем больше степень переохлаждения, тем больше центров кристаллизации и тем меньше размер зерна. Чем мельче зерно, тем выше механические свойства сплава.
Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотовая) или в подогретую металлическую форму. Увеличение переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливок. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получается более мелкий кристалл.
В реальных условиях процессы кристаллизации и характер образующейся структуры в значительной мере зависят от имеющихся центров кристаллизации. Такими центрами являются частицы тугоплавких неметаллических включений, оксидов, интерметаллических соединений, образуемых примесями. При кристаллизации атомы металла откладываются на активированные поверхности примеси как на готовом зародыше.
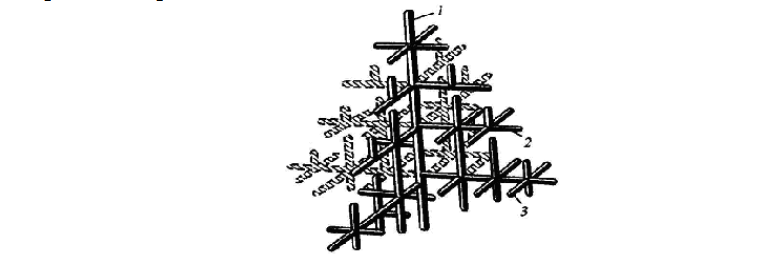
Наличие готовых центров кристаллизации приводит к уменьшению размеров кристалла при затвердевании. Рост зерна чаще всего происходит по дендритной схеме (рис. 5). Это связано с тем, что развитие зародышей протекает главным образом в тех направлениях решетки, которые имеют наибольшую плотность упаковки атомов и минимальное расстояние между ними. В этих направлениях образуются ветви — оси первого порядка I. От осей первого порядка начинают расти оси второго порядка II, от них — оси третьего порядка III и т. д.
Условия отвода теплоты при кристаллизации значительно влияют на форму зерен. Кристаллы растут преимущественно в направлении, обратном отводу теплоты. Поэтому при направленном теплоотводе образуются вытянутые (столбчатые) кристаллы. Если теплота от растущего кристалла отводится во всех трех направлениях с приблизительно одинаковой скоростью, формируются равноосные кристаллы.
Структура слитка зависит от многих факторов, основные из которых следующие:
- количество и свойство примесей в чистом металле или легирующих элементов в сплаве;
- температура разливки;
- скорость охлаждения при кристаллизации, а также конфигурация;
- температура;
- теплопроводность;
- состояние внутренней поверхности литейной формы.
Типичная структура литого слитка состоит из трех основных зон (рис. 6).
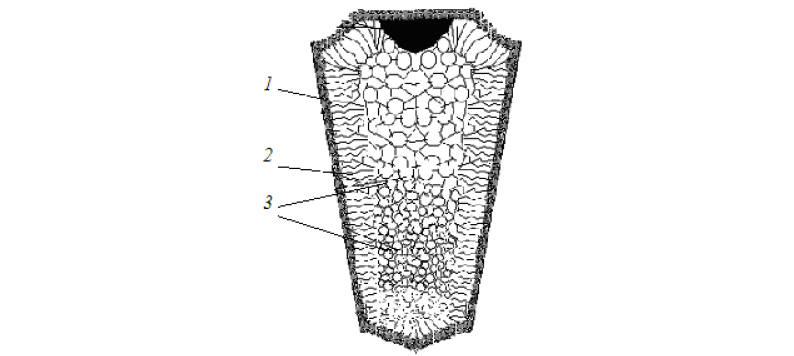
1 зона — наружная мелкозернистая корка, состоящая из мелких различно ориентированных кристаллов. Для этой зоны характерна большая степень переохлаждения, что ведет к образованию большого количества центров кристаллизации. Отсутствие направленного роста кристаллов этой зоны объясняется их случайной ориентацией, которая является причиной столкновения кристаллов и прекращения их роста. Эта зона очень тонка и не всегда различима невооруженным глазом.
2 зона — зона столбчатых кристаллов. После образования корки уменьшается степень переохлаждения и кристаллы растут в направлении отвода тепла.
3 зона — зона равноосных кристаллов. В центре слитка нет определенной направленности отвода тепла, наблюдается наименьшая степень переохлаждения, кристалл может расти практически с одинаковой скоростью по всем направлениям.
Применяя различные технологические приемы, можно изменить количественные соотношения зон или исключить из структуры слитка какую либо зону вообще. В верхней части слитка, которая затвердевает в последнюю очередь, концентрируется усадочная раковина. Под усадочной раковиной металл получается рыхлым, в нем содержится много усадочных форм. Часть слитка с усадочной раковиной и рыхлым металлом отрезают.
Превращения в твердом состоянии. Полиморфизм.
Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией. Многие металлы в зависимости от температуры могут существовать в разных кристаллических формах или разных модификациях. Существование одного металла в нескольких кристаллических формах носит название полиморфизма.
В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа. Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать буквой α, а при более высокой — β, γ и т. д.
| Металл | Кристаллическая структура | Температура существования модификации, °C |
| Титан | ГП ОЦК | До 882 882-1668 |
| Цирконий | ГП ОЦК | До 862 862-1852 |
| Олово | Алмазная ТОЦ | До 13 13-232 |
| Уран | Ромбическая ТОЦ ОЦК | До 663 663-764 764-1130 |
| Кобальт | ГП ГЦК | До 447 477-1490 |
При переходе металла из одной полиморфной модификации в другую происходит фазовая перекристаллизация, вследствие образования новых зерен в структуре металла. Можно считать, что процесс перекристаллизации при полиморфном превращении подчиняется тем же законам, что и процесс перекристаллизации. Полиморфное превращение прежде всего развивается в тех участках структуры, в которых уровень свободной энергии повышен. Такими участками являются границы зерен и приграничные области. Чем меньше размер зерна, тем больше межзеренная поверхность и тем больше возникает зародышевых центров. Температура, при которой осуществляется переход из одной модификации в другую, носит название температуры полиморфного превращения.
Переход металла из одной полиморфной модификации в другую в условиях равновесия протекает при постоянной температуре и сопровождается выделением тепла, если превращение идет при охлаждении, и поглощением тепла — при нагреве. На кривых охлаждения и нагрева переход из одного состояния в другой характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов).
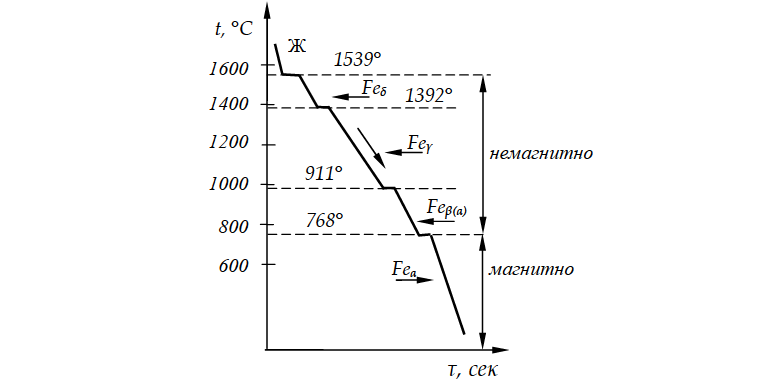
Рассмотрим явление полиморфизма на примере железа (рис. 7). Железо имеет две температуры полиморфного превращения — 1392 °C и 911 °C:
при t < 1392 °C; Feδ(α) ->Feγ; ОЦК -> ГЦК,
при t < 911 °C; Feγ ->Feα; ГЦК -> ОЦК.
При температуре 768 °C получается остановка на кривой охлаждения, связанная не с перестройкой решетки, а с изменением магнитных свойств. Железо отличается специфическими магнитными свойствами. Эти свойства называются ферромагнитными. При нагреве ферромагнитные свойства постепенно теряются. П. Кюри показал, что полная потеря ферромагнитных свойств получается при определенной температуре, названной впоследствии точкой Кюри. Выше 768 °C Feα немагнитно (немагнитное Feα иногда называют Feβ), ниже 768 °C железо ферромагнитно.
Магнитное превращение имеет ряд особенностей, отличающих его от полиморфического превращению. Магнитные свойства железа постепенно падают по мере приближения к точке превращения, и эта точка не отвечает скачкообразному изменению свойств:
- магнитное превращение не имеет температурного гистерезиса, увеличение скорости охлаждения не снижает температуры превращения;
- механические и некоторые физические свойства при превращении не изменяются, изменяются многие электрические, магнитные и тепловые свойства;
- магнитное превращение не сопровождается перекристаллизацией.
При магнитных превращениях происходит изменение не в кристаллической структуре металла, а во взаимодействии внешних и внутренних электронных оболочек атомов.
Полиморфное превращение сопровождается скачкообразным изменением свойств металлов или сплавов — удельного объема, теплоемкости, теплопроводности, электропроводности и т. д. Эти превращения происходят не только в чистых металлах, но и в сплавах.
